Na + H2O → NaOH + H2 là phản ứng oxi hóa khử. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng Na + H2O → NaOH + H2
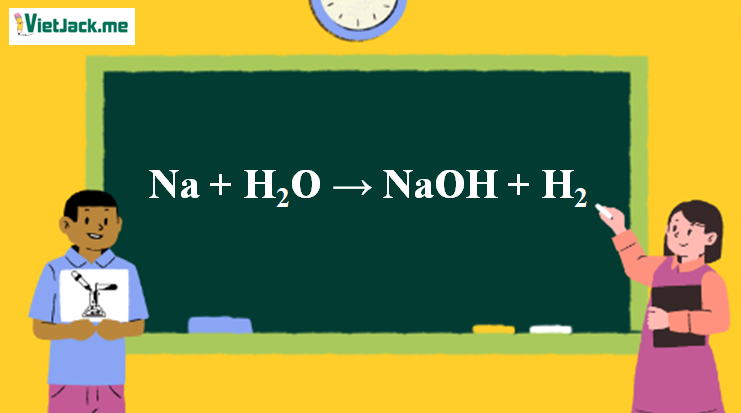
1. Phương trình Na tác dụng với H2O
2Na + 2H2O → 2NaOH + H2
2. Điều kiện phản ứng giữa kim loại Na với H2O
Không có
3. Cách thực hiện phản ứng kim loại Na với H2O
Cho mẫu natri vào cốc nước cất
4. Hiện tượng nhận biết phản ứng kim loại Na với H2O
Natri phản ứng với nước, nóng chảy thành giọt tròn có màu trắng chuyển động nhanh trên mặt nước. Mẫu Na tan dần cho đến hết, có khí H2 bay ra, phản ứng toả nhiều nhiệt. Làm bay hơi nước của dung dịch tạo thành, sẽ được một chất rắn trắng, đó là Natri Hidroxit NaOH
5. Tính chất hóa học của kim loại kiềm
Các nguyên tử kim loại kiềm đều có năng lượng ion hóa I1 thấp và thế điện cực chuẩn E0 có giá trị rất âm. Vì vậy kim loại kiềm có tính khử rất mạnh.
5.1. Tác dụng với phi kim
Hầu hết các kim loại kiềm có thể khử được các phi kim.
Thí dụ: kim loại Na cháy trong môi trường khí oxi khô tạo ra natri peoxit Na2O2. Trong hợp chất peoxit, oxi có số oxi hóa -1:
-
Tác dụng với Oxi
Natri cháy trong khí oxi khô tạo ra natri peoxit Na2O2, trong không khí khô ở nhiệt độ thường tạo ra natri oxit Na2O
2Na + O2 → Na2O2
2Na + 1/2O2 → Na2O
b) Tác dụng với Clo
2K + Cl2 → 2KCl
-
Với halogen, lưu huỳnh:
Các kim loại kiềm bốc cháy trong khí clo khi có mặt hơi ẩm ở nhiệt độ cao. Với brom lỏng, K, Rb, Cs nổ mạnh, Li và Na chỉ tương tác trên bề mặt. Với iot, các kim loại kiềm chỉ tương tác mạnh khi đun nóng. Khi nghiền kim loại kiềm với bột lưu huỳnh sẽ gây phản ứng nổ.
* Với nitơ, cacbon, silic: Chỉ có Li có thể tương tác trực tiếp tạo Li3N, Li2C2, Li6Si2 khi đun nóng.
5.2. Kim loại kiềm tác dụng với axit
Các kim loại kiềm đều có thể khử dễ dàng ion H+ của dung dịch axit (HCl, H2SO4 loãng) thành khí H2 (phản ứng gây nổ nguy hiểm):
2Li + 2HCl → 2LiCl + H2↑
Dạng tổng quát:
2M + 2H+ → 2M+ + H2↑
5.3. Kim loại kiềm tác dụng với nước H2O
Kim loại kiềm khử được nước dễ dàng, giải phóng khí hiđro:
2Na + 2H2O → 2NaOH (dd) + H2↑
Dạng tổng quát:
2M + 2H2O → 2MOH (dd) + H2↑
Do vậy, các kim loại kiềm được bảo quản bằng cách ngâm chìm trong dầu hỏa.
6. Tính chất hóa học của H2O
6.1. Nước tác dụng với kim loại
Ở điều kiện thường, nước có thể phản ứng với các kim loại mạnh như Li, Ca, Na, K, Ba,… để tạo thành dung dịch Bazo và khí Hidro.
H2O + Kim loại → Bazơ + H2↑
2M + 2nH2O → 2M(OH)n + nH2↑
2Na + 2H2O → 2NaOH + H2
2K + 2H2O → 2KOH + H2
Ca + 2H2O → Ca(OH)2 + H2
Ba + 2H2O → Ba(OH)2 + H2
Đặc biệt, một số kim loại trung bình như Mg, Zn, Al, Fe,…phản ứng được với hơi nước ở nhiệt độ cao tạo ra oxit kim loại và hidro. Bên cạnh đó, kim loại Mg tan rất chậm trong nước nóng.
6.2. Nước tác dụng với oxit bazo
Nước tác dụng với một số oxit bazo như Na2O, CaO , K2O,… tạo thành dung dịch bazo tương ứng. Dung dịch bazo làm cho quỳ tím hóa xanh.
H2O + Oxit bazơ → Bazơ
Na2O + H2O → 2NaOH
Li2O + H2O→ 2LiOH
K2O + H2O→ 2KOH
CaO + H2O → Ca(OH)2
6.3. Nước tác dụng với oxit axit
Nước tác dụng với oxit axit tạo thành axit tương ứng. Dung dịch axit làm quỳ tím hóa đỏ.
H2O + Oxit axit → Axit
CO2 + H2O → H2CO3
SO2 + H2O → H2SO3
P2O5 + 3H2O → 2H3PO4
SO3 + H2O → H2SO4
N2O5 + H2O → 2HNO3
7. Ứng dụng của NAOH
- Sản xuất các sản phẩm làm sạch và khử khuẩn
- Ứng dụng trong ngành y học - dược phẩm
- Ứng dụng trong chế tạo nguyên liệu, năng lượng
- Sử dụng trong xử lí nước
- Ứng dụng trong chế biến thực phẩm
- Ứng dụng trong các sản phẩm gỗ và giấy
8. Bài tập vận dụng
Câu 1. Có 2 lít dung dịch NaCl 0,5 M. Lượng kim loại và thể tích khí thu được (đktc) từ dung dịch trên là (hiệu suất điều chế bằng 90%)
A. 27,0 gam và 18,00 lít
B. 20,7 gam và 10,08 lít
C. 10,35 gam và 5,04 lít
D. 31,05 gam và 15,12 lít
Lời giải:
Đáp án: B
Giải thích:
nNaCl= 1 (mol)
Phương trình hóa học
2NaCl → 2Na + Cl2
1 1 0.5
mNa= 1x 23 x 90/100 = 20.7 (g)
VCl2 = 0.5 x 22.4 x 90/100 = 10.08 (l)
Câu 2. Khi cho kim loại Na vào dung dịch CuSO4 thì sẽ xảy ra hiện tượng nào sau đây ?
A. Ban đầu có xuất hiện kết tủa xanh, sau đó kết tủa tan ra, dung dịch trong suốt.
B. Ban đầu có sủi bọt khí, sau đó xuất hiện kết tủa xanh.
C. Ban đầu có sủi bọt khí, sau đó có tạo kết tủa xanh, rồi kết tủa tan ra, dung dịch trong suốt.
D. Chỉ có sủi bọt khí.
Lời giải:
Đáp án: B
Giải thích:
Ban đầu, Na sẽ tác dụng với nước trước tạo NaOH và sủi bọt khí, sau đó có kết tủa xanh và không tan
Câu 3. Cho 1,84 gam hỗn hợp gồm Al và Zn tác dụng với một lượng vừa đủ dung dịch H2SO4 10% thu được 1,12 lít khí H2 (ở đktc). Khối lượng dung dịch thu được sau phản ứng là
A. 50,74 gam.
B. 50,84 gam.
C. 47,40 gam.
D. 44,1 gam.
Lời giải:
Đáp án: A
Giải thích:
Ta có
nH2 = 1,12/22,4 = 0,05 mol → nH2SO4 = nH2= 0,05 mol
Khối lượng H2SO4 là: mH2SO4 = 0,05. 98 = 4,9 gam → mdd H2SO4 = (4,9.100)/10 = 49 gam
Khối lượng dung dịch sau phản ứng là:
mdd sau= mdd bđ+ mKL - mH2 = 49 + 1,84 - 0,05.2 = 50,74 gam
Câu 4. Đốt cháy hoàn toàn 6 gam hỗn hợp A gồm Al và Cu cần vừa đủ 2,912 lít hỗn hợp khí gồm O2 và Cl2 thu được 13,28 gam chất rắn. Phần trăm khối lượng của Al trong A là?
A. 36 %
B. 64%
C. 30%
D. 70%
Lời giải:
Đáp án: A
Giải thích:
Áp dụng định luật bảo toàn khối lượng
=> mO2 + mCl2 = mChất rắn – mKL = 13,28 – 6 = 7,28 gam
nO2+ nCl2 = 2,912:22,4 = 0,13 (mol)
Gọi số mol O2, Cl2 lần lượt là x, y
=> Ta có hệ phương trình:
x + y =0,13
32x + 71y = 7,28
=> x = 0,05; y = 0,08
Gọi số mol Al, Cu lần lượt là a, b
Áp dụng định luật bảo toàn electron:
=> Tổng lượng e nhường của kim loại bằng tổng lượng e nhận của phi kim (O2, Cl2)
=> 3a+ 2b = 4. nO2+ 2. nCl2
=> 3a + 2b = 4.0,05 + 2.0,08 = 0,36 (I)
Khối lượng của 2 kim loại bằng 3 gam
=> 27x + 64y = 6 (II)
Từ (I) và (II) => a = 0,08 ; b = 0,06
% Al = (0,08 . 27): 6 . 100% = 36%
Câu 5. Hỗn hợp X gồm Fe, FeO, Fe2O3. Cho một luồng khí CO đi qua ống sứ đựng m g hỗn hợp X nung nóng. Sau khi kết thúc thí nghiệm thu được 64 g chất rắn A và 11,2 lít khí B (đktc) có tỉ khối so với hiđro là 20,4. Giá trị của a là
A. 70,40 gam
B. 35,20 gam
C. 30,12 gam
D. 46,93 gam
Lời giải:
Đáp án: A
Giải thích:
Gọi x, y lần lượt là số mol của: nCO = x (mol); nCO2 = y (mol)
Theo đề bài
nhh = 11,2/22,4 = 0,5 mol
Ta có hệ phương trình:
nhh= x + y = 0,5
mhh= 28x + 44y = 0,5.(20,8.2)
x = 0,1
y = 0,4
nCOpư = nCO2= 0,4 mol
Bảo toàn khối lượng: mCOpu + mX = mA+ mCO2
→ mX = 64 − 0.4 (44 − 28) = 70,4 gam
Câu 6. Cho thanh sắt Fe vào dung dịch X chứa 0,2 mol AgNO3 và 0,4 mol Cu(NO3)2. Khi thấy thanh kim loại tăng lên 17,6 gam thì dừng lại. Tính khối lượng kim loại bám vào thanh sắt
A. 17,2 gam
B. 34,4 gam
C. 16,8 gam
D. 24,6 gam
Lời giải:
Đáp án: A
Giải thích:
nAg+ = 0,1 mol;
nCu2+ = 0,2 mol
Nếu Ag+ phản ứng hết :
Fe + 2Ag+ → Fe2+ + 2Ag
0,1 ← 0,2 → 0,2
=> mtăng = 0,2.108 – 0,1.56 = 16 < 17,6
=> Ag+ phản ứng hết; Cu2+ phản ứng 1 phần
Fe + Cu2+ → Fe2+ + Cu
x → x → x
=> mtăng = 64x – 56x = 16x
=> tổng khối lượng tăng ở 2 phản ứng là:
mtăng = 16 + 16x = 17,6 => x = 0,1 mol
=> mkim loại bám vào = mAg + mCu= 17,2 gam
Câu 7. Khẳng định nào sau đây là đúng?
A. Bari là nguyên tố có tính khử mạnh nhất trong dãy kim loại kiềm thổ
B. Tất cả các kim loại kiềm thổ đều tan trong nước ở nhiệt độ thường
C. Kim loại kiềm thổ có tính khử mạnh hơn kim loại kiềm
D.Tính khử của các kim loại kiềm thổ tăng dần từ Be đến Ba.
Lời giải:
Đáp án: D
Giải thích:
Mg và Be không phản ứng với nước ở điều kiện thường B sai.
Đi từ đầu nhóm IIA đến cuối nhóm theo chiều tăng dần điện tính hạt nhân tính kim loại (tính khử) tăng dần => Kim loại mạnh nhất là Ra; yếu nhất là Be. => A sai, D đúng.
Nhóm Kim loại kiềm có tính khử mạnh nhất => C sai.
Câu 8. Hãy chọn phản ứng giải thích sự xâm thực của nước mưa với đá vôi và sự tạo thành thạch nhũ trong các hang động?
A. Do phản ứng của CO2 trong không khí với CaO tạo thành CaCO3
B. Do CaO tác dụng với SO2 và O2 tạo thành CaSO4
C. Do dự phân hủy Ca(HCO3)2 → CaCO3 + CO2 + H2O
D. Do quá trình phản ứng thuận nghịch: CaCO3 + H2O + CO2⇆ Ca(HCO3)2 xảy ra trong 1 thời gian rất lâu
Lời giải:
Đáp án: D
Giải thích:
Phản ứng giải thích sự xâm thực của nước mưa với đá vôi và sự tạo thành thạch nhũ trong các hang động là quá trình phản ứng thuận nghịch: CaCO3 + H2O + CO2 ⇆ Ca(HCO3)2 xảy ra trong 1 thời gian rất lâu
Câu 9. Câu nào không đúng khi nói về canxi?
A. Nguyên tử Ca bị oxi hóa khi Ca tác dụng với H2O
B. Ion Ca2+ bị khử khi điện phân CaCl2 nóng chảy
C. Nguyên tử Ca bị khử khi Ca tác dụng với O2
D. Ion Ca2+ không bị oxi hóa hay bị khử khi Ca(OH)2 tác dụng với HCl
Lời giải:
Đáp án: C
Giải thích:
Câu không đúng là: Nguyên tử Ca bị khử khi Ca tác dụng với O2.
Phương trình hóa học: 2Ca + O2 → 2CaO => Ca bị oxi hóa khi tác dụng với O2.
Câu 10. Nhận định nào sau đây không đúng về kim loại kiềm?
A. Đều có cấu tạo mạng tinh thể giống nhau: lập phương tâm khối.
B. Dễ bị oxi hóa.
C. Năng lượng ion hóa thứ nhất của các nguyên tử kim loại kiềm thấp hơn so với các nguyên tố khác trong cùng chu kì.
D. Là những nguyên tố mà nguyên tử có 1 e ở phân lớp p.
Lời giải:
Đáp án: B
Giải thích:
Nhận định nào sau đây không đúng về kim loại kiềm?
Dễ bị oxi hóa. => dễ bị khử
Câu 11. Dung dịch kiềm không có những tính chất hóa học nào sau đây
A. Tác dụng với oxit bazơ
B. Tác dụng với axit
C. Tác dụng với dung dịch oxit axit
D. Bị nhiệt phân hủy
Lời giải:
Đáp án: A
Câu 12. Dung dịch KOH không có tính chất hoá học nào sau đây?
A. Làm quỳ tím hoá xanh
B.Tác dụng với oxit axit tạo thành muối và nước
C.Tác dụng với axit tạo thành muối và nước
D. Bị nhiệt phân huỷ tạo ra oxit bazơ và nước
Lời giải:
Đáp án: D
Câu 13. Khi điều chế Na, người ta điện phân nóng chảy NaCl với anot làm bằng:
A. thép
B. nhôm.
C. than chì.
D. magie.
Lời giải:
Đáp án: C
Câu 14. Cho các phát biểu sau về ứng dụng của kim loại kiềm :
(1) Kim loại kiềm dùng để chế tạo hợp kim có nhiệt độ nóng chảy thấp,
(2) Kim loại kiềm dùng để điều chế một số kim loại hiếm bằng phương pháp nhiệt kim loại.
(3) Kim loại kiềm dùng đề làm xúc tác trong nhiều phản ứng hữu cơ.
(4) Kim loai kiềm dùng để làm điện cực trong pin điện hóa
(5) Kim loại kiềm dùng để gia công các chi tiết chịu mài mòn trong máy bay, tên lửa, ô tô
Trong các phát biểu trên, số phát biểu đúng là:
A. 1.
B. 2.
C. 3.
D. 4
Lời giải:
Đáp án: C
Giải thích:
(1) Kim loại kiềm dùng để chế tạo hợp kim có nhiệt độ nóng chảy thấp,
(2) Kim loại kiềm dùng để điều chế một số kim loại hiếm bằng phương pháp nhiệt kim loại.
(3) Kim loại kiềm dùng đề làm xúc tác trong nhiều phản ứng hữu cơ.
Câu 15. Cho 3,36 gam hỗn hợp gồm K và một kim loại kiềm A vào nước thấy thoát ra 1,792 lít H2. Thành phần phần trăm về khối lượng của A là
A. 18,75 %.
B. 10,09%.
C. 13,13%.
D. 55,33%.
Lời giải:
Đáp án: A
Giải thích:
Gọi công thức chung của 2 kim loại kiềm là M
Phản ứng xảy ra
M + H2O→ MOH + 1/2H2
nM = 2nH2 = 0,16 mol => M = 3,36/0,16 = 21
=> Li (7)< M = 21 < K (39)
Gọi số mol của K và Li lần lượt là x và y:
Ta có:
% mLi = 0,09.7/3,36 .100% = 18,75%
Câu 16. Phát biểu nào sau đây là sai khi nói về 2 muối NaHCO3 và Na2CO3?
A. Cả 2 muối đều dễ bị nhiệt phân.
B. Cả 2 muối đều tác dụng với axit mạnh giải phóng khí CO2.
C. Cả 2 muối đều bị thủy phân tạo mỗi trường kiềm yếu.
D. Cả 2 muối đều có thể tác dụng với dung dịch Ca(OH)2 tạo kết tủa.
Lời giải:
Đáp án: A
Giải thích:
A sai vì Na2CO3 không bị nhiệt phân
B, C, D đúng
Câu 17. Cho các chất sau : Na, Na2O, NaCl, NaHCO3, Na2CO3. Số chất có thể tạo ra NaOH trực tiếp từ một phản ứng là:
A. 2
B. 3
C. 4.
D. 5.
Lời giải:
Đáp án: D
Giải thích:
Các chất đó là: Na2O; NaCl; Na2CO3, NaHCO3, Na
Na + H2O → NaOH + H2
Na2O + H2O → NaOH
2NaCl + 2H2O 2NaOH + H2 + Cl2
Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3↓
NaHCO3 + Ba(OH)2 → BaCO3↓ + NaOH + H2O
=> cả 5 chất đều có thể điều chế trực tiếp ra NaOH bằng một phản ứng.
Câu 18: Đặt một mẩu nhỏ natri lên một tờ giấy thấm gấp thành dạng thuyền. Đặt chiếc thuyền giấy này lên một chậu nước có nhỏ sẵn vài giọt phenolphtalein.
Dự đoán hiện tượng có thể quan sát được ở thí nghiệm như sau :
(a) Chiếc thuyền chạy vòng quanh chậu nước.
(b) Thuyền bốc cháy.
(c) Nước chuyển màu hồng.
(d) Mẩu natri nóng chảy.
Trong các dự đoán trên, số dự đoán đúng là:
A. 1.
B. 2.
C. 3.
D. 4.
Lời giải:
Đáp án: D
Câu 19. Trong nhóm kim loại kiềm thổ:
A. Tính khử của kim loại tăng khi bán kính nguyên tử tăng
B. Tính khử của kim loại tăng khi bán kính nguyên tử giảm
C. Tính khử của kim loại giảm khi bán kính nguyên tử tăng
D. Tính khử của kim loại không đổi khi bán kính nguyên tử giảm
Lời giải:
Đáp án: A
Giải thích:
Tính khử của kim loại tăng khi bán kính nguyên tử tăng
Câu 20. Để điều chế kim loại Na, người ta thực hiện phản ứng:
A. Điện phân dung dịch NaOH.
B. Điện phân nóng chảy NaCl hoặc NaOH .
C. Cho dung dịch NaOH tác dụng với dd HCl.
D. Cho dung dịch NaOH tác dụng với H2O.
Lời giải:
Đáp án: B
Giải thích:
Điện phân nóng chảy NaCl hoặc NaOH .
Xem thêm các phương trình phản ứng hóa học khác:
Ba + H2O → Ba(OH)2 + H2
BaO + H2O → Ba(OH)2
Ba(HCO3)2 + NaOH → BaCO3 + Na2CO3 + H2O
C + H2SO4 → SO2 + CO2 + H2O
C + CO2 → CO